针对I类医疗器械制造商的MDCG指南
I类医疗器械制造商的MDCG指南
欧盟委员会的咨询机构医疗器械协调小组(MDCG)已向最初于2019年12月发布的I类医疗器械制造商发布了指导说明的第一版;特别是,该文件旨在为医疗器械制造商提供以及涉及在MDR推迟的情况下遵守适用法规的建议的其他各方。
本MDCG指南针对打算在欧盟内销售其产品的I类医疗设备制造商,该文档中提供的建议也可以由参与医疗器械运营的其他各方使用,包括但不限于打算进入欧盟市场的外国医疗器械制造商的进口商,分销商和授权代表。MDCG还强调,该文件并不构成对新的《 2017/745医疗器械法规》的明确解释–该文档包含的建议不具有约束力且不可执行。

MDCG指出,MDR的范围实际上比以前由MDR取代的医疗器械指令所涵盖的范围更大,因为它涵盖了医疗器械制造商和其他参与供应链的实体。从特定于设备的角度来看,新法规的范围还涵盖了不是医疗器械但打算在适当情况下使用的产品(例如,用于医疗器械的清洁,消毒或灭菌)。
MDR下的医疗器械制造商义务
根据MDR,为了允许其销售医疗器械,制造商应:
证明符合MDR并符合适用的安全和性能要求, 贴上CE标志,提交合格声明。
为了涵盖上述几点,制造商应:
1.实施质量管理体系和风险管理体系;
2.进行临床评估,进行合格评定(对于无菌医疗设备,具有测量功能的设备或可重复使用的手术器械应包括认证机构);
3.准备根据要求提供的技术文档, 准备一份欧盟符合性声明;
4.在电子系统(Eudamed)中注册为实体,并获得用于后续通信的单一注册号(SRN),在Eudamed系统中注册有问题的设备,然后分配基本UDI-DI。
5.将UDI分配给设备本身及其包装,以便可以在设备生命周期内使用UDI识别和跟踪设备。
![]()
6.随设备一起提供信息,以识别制造商。设备随附的信息还应涵盖最重要的安全性和性能方面,并应以欧盟的官方语言提供(取决于要销售该医疗设备的特定成员国)。
7.建立与基于风险分类的医疗器械类别相对应的适当的售后监督系统(作为质量管理体系的组成部分)。
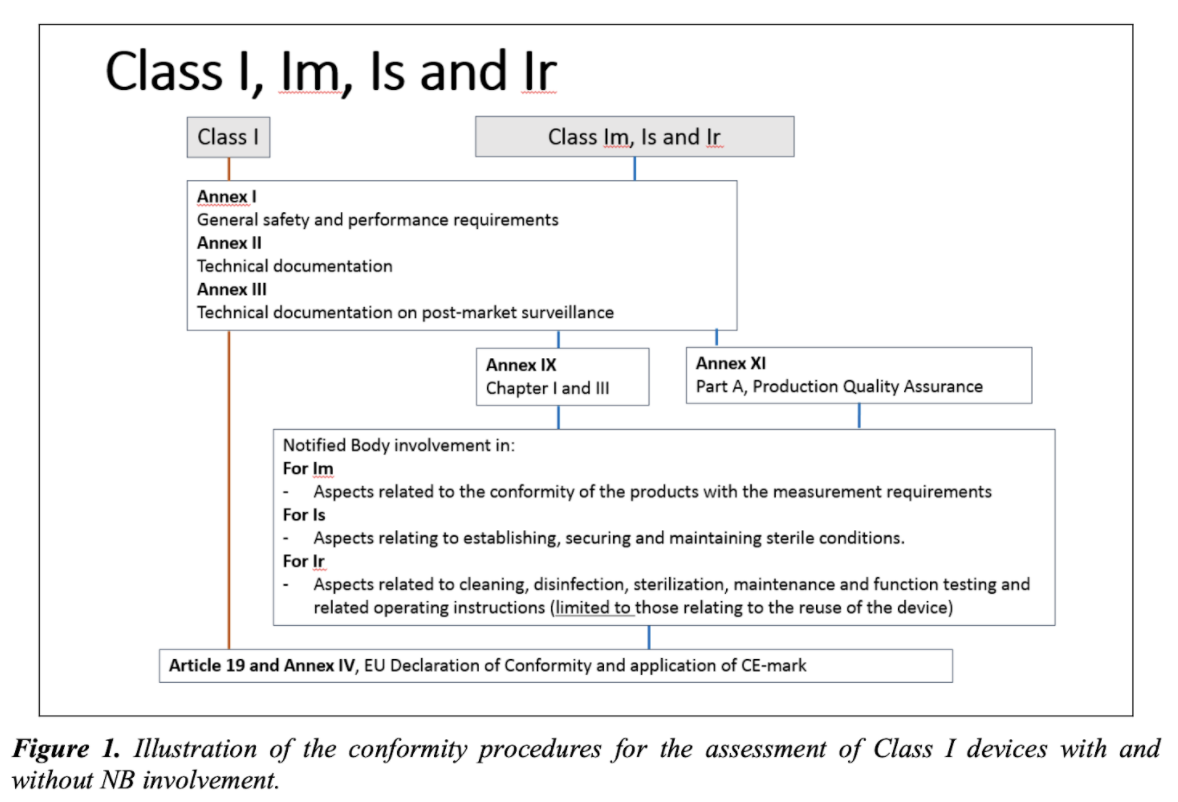
将I类医疗设备投放到欧盟市场
MDCG指南描述了医疗设备制造商将其设备投放到欧洲市场时要执行的程序,整个过程包括一组强制性步骤,即:
1.MDR集成在质量管理系统(QMS)中,MDR中规定的要求应适当地集成到制造商建立的QMS中。
2.确认所涉及的产品是医疗设备,因此应根据MDR进行管理;该确定应基于制造商指示的预期医疗目的进行。
3.确认要检查的医疗设备是I类医疗设备,初始分类应由医疗设备制造商执行;但是,如有任何疑问,应由监管机构做出最终决定;如果由于其功能而使该设备属于多个分类规则的范围,则应使用级别最高的设备。

4.销售设备之前要执行的程序(风险管理系统的实施,临床评估,技术文档的准备,使用和标记的说明以及要求公告机构参与(如果适用))。
5.检查对制造商的一般义务的合规性(包括合规性策略)。
6.起草欧盟合格声明。该声明应包含根据MDR要求在有关医疗器械上的所有信息,并应提供给主管当局。
7.贴上CE认证,表明该医疗设备符合适用的安全和性能要求,并允许在欧盟销售。对于需要指定机构参与的设备,CE标记应附有进行合格评定的指定机构的编号。
总结以上提供的信息,MDCG指南描述了将I类医疗设备投放到欧盟市场的方式。该指南的范围还包括无菌医疗器械(Is类),具有测量功能的器械(Im类)以及可重复使用的手术器械(Ir类)–要求公告机构参与上市前的医疗器械类型程序。









